CAR-T细胞治疗
CAR-T细胞治疗指的是嵌合抗原受体T细胞(Chimeric Antigen Receptor T-Cell,CAR-T)免疫疗法。该技术很多年前就已出现,但是近几年才被改良应用到临床的一种新型细胞疗法,它在急性白血病和非霍奇金淋巴瘤的治疗上有着显著的疗效,被认为是目前最有前景的肿瘤治疗方式之一。其原理是通过基因工程手段修饰人的T细胞,使其表达嵌合抗原受体(CAR),即将识别肿瘤细胞表面抗原的抗体与激活T细胞所需的信号分子连接,以此增强T细胞对肿瘤的特异性杀伤,治疗过程如下图所示。
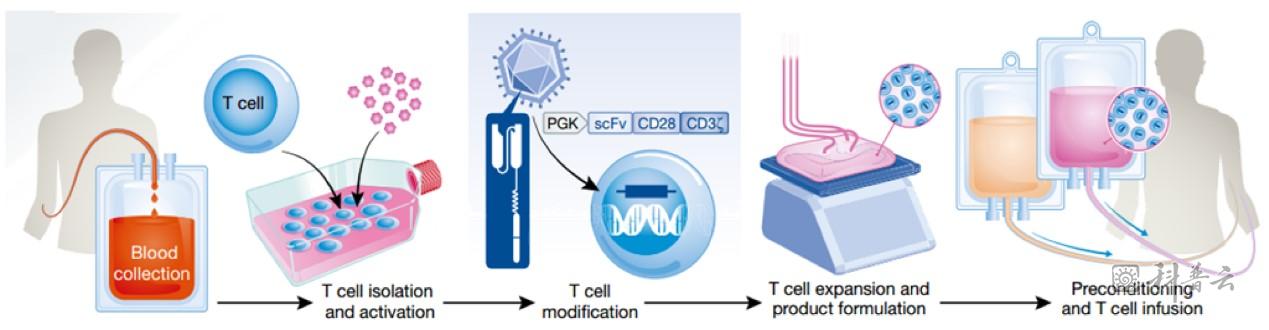
CAR-T细胞治疗流程图(图片来自网络)
CAR-T细胞治疗安全性的典型案例
CAR-T细胞疗法虽然对于多种血液肿瘤有着较好的疗效,但也存在着一定的安全挑战。2017年9月5日,FDA因安全原因紧急叫停法国Cellectis公司正在进行的CAR-T试验。该公司首个人体试验对象是一名78岁患急性浆细胞样树突状细胞肿瘤的患者,该受试者在接受首次注射后8天去世,死亡原因是细胞因子释放综合征(Cytokine release syndrome,CRS)以及毛细血管渗漏综合征。CRS是CAR-T细胞接触带有肿瘤抗原的细胞后大量增殖,并对肿瘤细胞大量杀伤,在此过程中产生一系列细胞因子,形成细胞因子风暴,对患者身体造成系列性相关损害的综合征。CRS临床表现多样,主要有高热、乏力、疲劳、肌痛、恶心、厌食、心动过速、低血压、毛细血管渗漏、心功能不全、肾损害、肝衰竭、弥漫性血管内凝血等。
CAR-T细胞治疗过程中存在的安全性问题
CAR-T细胞治疗过程中存在一些安全问题,临床表现主要包括:细胞因子释放综合征、神经系统毒性、脱靶效应和其他风险。
1.细胞因子释放综合征(CRS)
细胞因子释放综合征是CAR-T细胞治疗最严重和最常见的并发症。法国Cellectis公司在使用CAR-T治疗过程中患者死亡的原因也正是CRS。CAR-T细胞一旦进入身体,就开始大量释放被称为细胞因子的蛋白质,这些蛋白质召唤免疫系统的其他成分来加入肿瘤细胞的攻击。所造成的冲击可能会产生危险的高热,极度疲劳,呼吸困难,血压急剧下降,这种情况对于严重的癌症患者尤其严重。严重的细胞因子风暴还会导致致命的神经系统毒性,称为CAR-T细胞相关性脑病综合征(CAR-T cell related encephalopathy syndrome,CRES),有时可导致致命性脑水肿。
2.神经系统毒性
神经系统毒性的发病几率与CRS相比要低很多。患者的临床表现包括精神错乱、谵妄、表达性失语、迟钝、肌阵挛、癫痫发作等。就目前研究看来,细胞因子水平升高与神经系统症状有关似乎是合理的解释,也有研究认为是CAR-T细胞毒性对中枢神经系统的直接作用,但这些尚未被证实。在出现神经系统不良反应的患者中,目前的临床信息还不能说明脑脊液中CAR-T细胞的数量与中枢神经系统症状是否具有相关性。目前,神经系统不良反应在大多数病例中是可逆的,目前尚不清楚这种不良反应是局限于CD19特异性CAR-T还是其他肿瘤相关抗原也会存在。
3.脱靶效应
脱靶效应也是CAR-T治疗过程中比较常见的一个副作用。脱靶效应的存在主要是因为CAR-T针对的靶抗原多为肿瘤相关抗原,而并非肿瘤特异性抗原,除了在肿瘤组织中有表达外,在正常组织中也存在不同程度的表达。因而对靶抗原亲和力和杀伤力强的CAR-T细胞在清除肿瘤的同时也会攻击正常组织,对组织器官造成损伤,产生脱靶效应。
4.其他风险
少量患者在接受CAR-T治疗后会出现毛细管渗透综合征(CLS)。CLS是一种突发的、可逆性毛细血管高渗透性,血浆迅速从血管渗透到组织间隙,迅速出现进行性全身性水肿、低蛋白血症、血压及中心静脉压均降低,严重时可发生多器官功能衰竭。此外儿童在使用CAR-T细胞疗法时还存在排斥反应的可能,主要因为儿童T细胞的TCR发育尚不完全,对外来抗原的识别和排异反应相对较弱。
CAR-T细胞治疗安全性的临床应对
针对CAR-T细胞治疗过程中存在的安全性问题,临床目前已有一些针对性的应对方法。对于炎症因子综合征,一方面需要对症进行机械通气、升压、透析等治疗;另一方面更需要针对CRS的本质进行免疫抑制治疗,以有效控制CRS的进展。临床上以抗IL-6受体单克隆药物托珠单抗为代表的细胞因子拮抗剂和糖皮质激素被广泛使用,情况严重时需采用激素(地塞米松、甲强龙等)处理。对于CAR-T治疗引起的神经毒性,轻微的临床症状能够在几天内自行缓解,严重的则可能需要单独或与地塞米松的支持治疗,可在4周内完全缓解。对于脱靶效应,则更多的需要从研发层面解决这一问题。
CAR-T细胞输注剂量的控制也是治疗过程提前预防多种安全性问题的重要手段。CAR-T细胞注入体内后扩增可达1000倍以上,其激活产生的大量细胞因子可能产生CRS,高剂量的CAR-T细胞输注可能导致CRS出现更早更凶险,以至于来不及进行治疗,因而对于CAR-T细胞输注剂量的控制显得尤其重要。目前各临床试验中嵌合抗体结构、T细胞培养方法及患者情况各不相同,尚无法对剂量递增方案进行统一规定,临床医师应根据临床前实验结果,结合患者个体肿瘤类型、肿瘤负荷做出具体调整。
CAR-T细胞研发过程中对于安全性的控制
CAR-T细胞临床治疗过程中出现的多种安全性问题,可以在后续的研发过程中对CAR-T结构进行优化,从而实现CAR-T细胞治疗的安全可控,主要策略包括:安装自杀基因、开关分子设计、构建双靶点CAR-T和优化基因转导方式。
1.安装自杀基因
自杀基因是指在CAR-T细胞中导入一个共表达的病毒或细菌基因,当不良反应发生时,在无毒性前导药物刺激下,激活CAR-T细胞中这些病毒或细菌基因表达,诱导CAR-T细胞凋亡,从而减少毒性。
2.通过开关分子选择性的激活CAR-T细胞
设计CAR-T细胞和肿瘤细胞抗原结合时通过特异性抗体连接,当CAR-T细胞与特异性抗体同时给患者输注时,CAR-T细胞就能通过特异性抗体和肿瘤细胞结合,达到杀伤肿瘤细胞的功能;当肿瘤细胞被清除以后,只要不再输注特异性的抗体,由于CAR-T细胞中CAR的设计并不直接针对肿瘤细胞,CAR-T细胞就不能再和肿瘤细胞结合发挥其对肿瘤细胞的特异性免疫杀伤作用。
3.构建双特异性CAR-T细胞和ICAR
第一种途径是在CAR-T细胞中同时表达CAR和iCAR。iCAR是经过改造的抑制性受体(如PD-1和CTLA-4),能够识别正常组织呈递的抗原。这样在和正常组织接触时,CAR-T细胞的活性被抑制,而只有在和癌细胞接触时,CAR-T细胞才能被激活,发挥杀伤作用。第二种途径是在CAR-T细胞中同时表达识别第一抗原的CAR和第二抗原的嵌合共刺激受体(CCR),只有目标细胞同时表达这两种抗原才会持续激活CAR-T细胞,增加了CAR-T细胞杀伤作用的特异性。
4.优化基因转导方式
目前在CAR-T细胞构建中主要采用慢病毒载体介导嵌合受体感染T细胞,使得CAR能够在细胞膜上表达。考虑到慢病毒整合宿主染色体的特性,已有使用慢病毒载体导致T淋巴瘤的报道,因此临床使用存在安全性风险。改变基因转导方式可以在一定程度上解决该问题:使用无法整合宿主细胞具有更高安全性的腺病毒载体,CAR瞬时表达的T细胞通过多次回输仍可以达到良好的抗肿瘤效果;还可以使用非病毒载体,例如具有生物降解功能的纳米颗粒,可实现CAR基因的体内转染,降低慢病毒转染的风险。
CAR-T细胞疗法作为一种新的治疗技术,已在血液肿瘤治疗领域取得了突破性进展,然而任何一种新技术都注定不是完美的,CAR-T细胞疗法针对实体瘤的治疗效果有待提高,并且它在治疗过程中所产生的毒副作用也使它的使用风险有所升高。目前,科学家们正努力为其临床使用的安全性进行研究和优化,并已经有许多优化思路在逐渐应用于临床试验,提高CAR-T细胞治疗的安全性。相信在不久的未来,随着CAR-T细胞技术的不断优化,CAR-T细胞治疗的安全性将逐渐提高,这势必会为越来越多的肿瘤患者带来福音。