来源:科学公园
2017年诺贝尔生理学或医学奖揭晓,三位美国科学家:纽约洛克菲勒大学的迈克尔·杨(Michael Young)、缅因大学的杰弗里·霍尔(Michaelrey Rosbash)和波士顿布兰迪斯大学的迈克尔·罗斯巴什(Michael Rosbash)因在生物昼夜节律控制分子机制方面的卓越工作而获奖。


什么样的成就
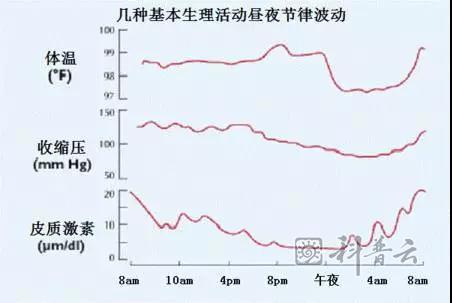
用最简单的一句话来说,这一成就帮助我们理解和解释了下图中列举的人类生理活动为什么随着昼夜更替而呈现周期性变化。


这就是由昼夜蛋白水平涨落主导的昼夜周期分子机制。
今年的获得者首先在果蝇分离并鉴定出一个控制正常昼夜生物节律的周期基因。他们的研究表明,该基因编码一种在夜间在细胞中积聚白天降解的蛋白质。随后,他们发现了这种分子机器的其他蛋白质组分,揭示了控制细胞内自控式的钟表发条机制。
至于昼夜周期如何影响多种生理功能的昼夜周期改变,还需要其他分子机制,比如睡眠昼夜周期中诱发睡眠的褪黑素和唤醒作用的皮质醇的分泌。
而且,所有生物的所有生理功能和行为都具有周期性。24小时昼夜节律仅仅是这些周期节律性的一种。
今年诺贝尔生理学或医学奖工作仅仅是给出昼夜节律主要的分子机制。其他的,长于24小时、短于24小时的生理节律还别有其他分子机制。
那么,这项成就更具体的工作有哪些呢?
研究历程和贡献
地球上的生命都会适应于地球的旋转,大多数生物体预测和适应环境昼夜变化。
早在18世纪,天文学家让·雅克·德奥图斯·德马兰就对含羞草白天叶子朝向太阳开放,晚上闭合的现象进行了研究。他将这种植物置于持续的黑暗中,结果发现含羞草并没有受日照的影响。叶子依然故我按照固有的节律开放闭合。

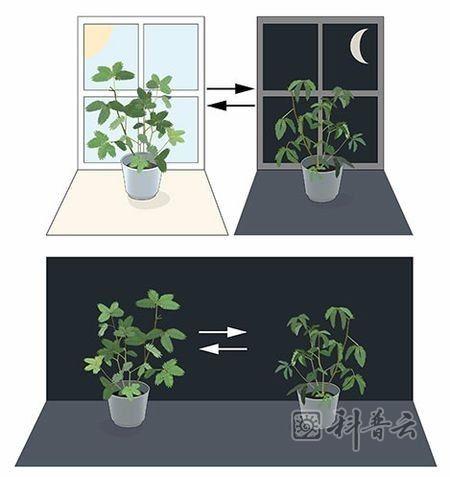
这说明,植物本身似乎存在调节自身行为的生物钟。
其他研究人员还发现,不仅植物,在动物和人类,体内都有这种类似的生物钟,调控我们每天的生理波动。这种就是所谓的昼夜节律。
然而,生物钟是如何工作的呢?
20世纪70年代,有研究人员发现,发生某种未知的基因突变的果蝇的这种昼夜节律被打乱。这说明果蝇体内存在着控制昼夜节律的基因,并将这种基因命名为周期基因(per)。
然而,这种周期基因如何影响昼夜节律?今年的诺贝尔奖得主的系列工作给出了答案。
1984年,在波士顿布兰迪斯大学的杰弗里·霍尔和迈克尔·罗斯巴什,纽约洛克菲勒大学迈克尔·杨成功地分离和鉴定了周期基因。随后,杰弗里·霍尔和迈克尔·罗斯巴什还成功发现这种基因编码的被命名为PER的蛋白质,这种蛋白质在夜间积累,白天降解,细胞内这种蛋白质的水平在每天24小时的周期内与昼夜节律同步波动。
然而,这种蛋白水平为什么会产生随昼夜节律的波动呢?
杰弗里·霍尔和迈克尔·罗斯巴什假设PER蛋白阻断了周期基因的活性,通过抑制反馈阻止自身的合成,从而以连续的循环节律调节其自身的水平波动。

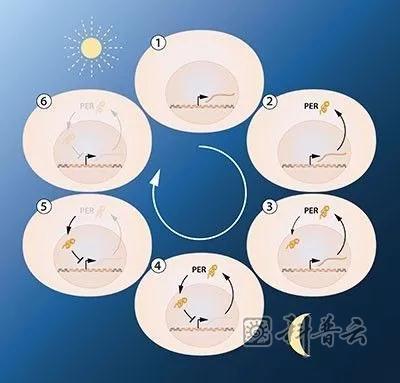
这种模型虽然是诱人的,蓝图中中却短缺几个拼图。那就是,要实现这种自我反馈抑制,这种蛋白质首先必须从合成工厂所在的细胞质返回到细胞核。虽然,两位研究者也已经成功证明在夜间这种蛋白的确发现在了细胞核中。
但是,它们是如何到达细胞核的呢? 1994年,迈克尔·杨发现了另一种没有时间波动性的时钟基因,它编码正常昼夜节律所需的TIM蛋白。并证明,当TIM与PER结合时,两种蛋白质就能够携手进入细胞核,在那里它们阻断周期基因活动以构建起了抑制反馈完整的环。
这种自我调节的反馈机制解释了细胞蛋白水平的节律性波动,但是问题依然没有彻底解决。那就是,是什么控制波动的频率呢?迈克尔·杨随后确定了另一个基因,编码DBT蛋白,这种蛋白质在细胞内延缓了PER蛋白的积累,很好的解释这种蛋白水平波动是调整以更紧密地匹配24小时昼夜节律变化。
在接下来的几年中,获奖者其他的工作阐明了生物钟这种发条机制的其他分子组分,完成了生物钟构建和工作稳定性的原理。
这项研究的应用性意义
有人说,这是一项纯基础研究,虽然意义重大,但是并没有应用价值。果真如此吗?其实不然。
这项成就不仅解释了包括人类在内的生物体如何适应和预适应自然界昼夜周期变化,同时可以解释人的行为未被人体固有的昼夜节律为什么会导致疾病,哪些疾病在什么时间更容易发作,以及开发针对性预防和治疗措施都具有很大的实际应用价值。比如,我们知道,人类睡眠是最为经典的昼夜周期性行为,经常熬夜可能增加肥胖、糖尿病、心血管病甚至癌症风险。这是为什么?
没有今年诺贝尔生理学或医学奖获奖的昼夜分子钟理论,这些只能停留在现象观察或者像中医子午流注那样胡乱解释的阶段。
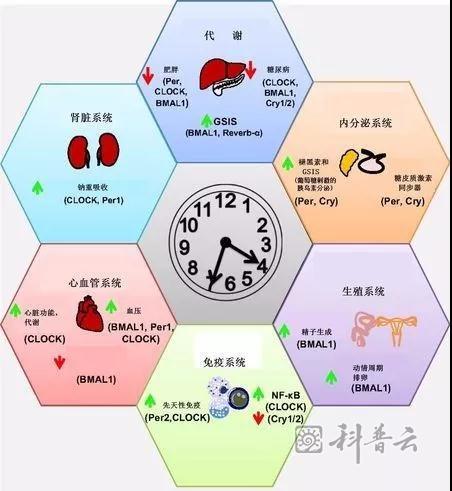
具体来说,生物钟在哪些生理或疾病发生机制中发挥作用呢?这么说吧,几乎每一项生理过程的调控,和与之有关的很多疾病发生都存在内在关联。在心血管系统、肾功能、代谢、内分泌系统、免疫系统和生殖系统的调节和疾病风险方面,目前有分子水平研究证据的作用概述如下:

心血管系统
早已观察到,收缩压和心率在每个24小时呈周期性波动,夜间通常显著低于白天。在多个昼夜节律基因敲除实验动物证实,这种周期性变化与昼夜时钟蛋白表达存在显著相关。心脏病和中风发作通常在清晨达到顶峰,是众所周知的现象。这是由于早晨血压和心率急剧上升,导致心脏氧需求显著增加的结果。还观察到,缺血损伤的程度也表现出昼夜节律,这与凝血溶血活性的昼夜节律相一致。
另外,与心脏病发生相关的内皮功能障碍、医学血管活性物质都存在昼夜节律变化。
肾脏功能
观察到包括肾血流量、肾小球滤过率、钾和钠排泄等多个肾功能都表现出昼夜节律。在昼夜节律基因敲除小鼠研究表明,昼夜周期蛋白Per1通过调节钠重吸收影响多项肾功能和血压。
代谢系统
昼夜时钟在代谢中的作用是另一个被广泛研究的热点。证据显示,在肝脏、心脏、胰腺和肾脏相关的某些代谢都存在显著昼夜节律。
大量研究发现肥胖和糖尿病病理生理变化与代谢昼夜节律存在相助相关。这可以解释很多观察研究发现的,在正确的时间进食比控制食物摄入量显示出更好的减肥效果的原因,也为“过午不食”有助于减肥这类说法提供了理论支持。
内分泌系统
几乎所有的激素分泌都具有明显的昼夜节律变化。比如,我们去医院内分泌科或妇科进行多项内分泌激素检查时,往往被要求在多个时间点分别抽取血液样本进行检查,就是为了反映这些激素的时间节律性变化。
而且研究也已经发现皮质醇、褪黑素、女性生殖激素分泌中周期蛋白调控的系列证据。其中,糖皮质激素昼夜节律性获得很好地研究。按下繁琐的研究证据不提,已知糖皮质激素的分泌对睡眠和觉醒周期具有显著调节作用。比如,一般早晨6点钟左右皮质醇恩米出现高峰,研究已知很大一箱作用就是告诉人们,该起床了,醒醒吧。
这些年来,静脉输注糖皮质激素在国内被广泛用于发烧退热,很多人尤其是孩子们在被输液后晚上往往难以入睡或者易醒,就是输液中的地塞米松干扰了正常睡眠节律给闹的。
说起睡眠,已知脑松果体在晚上9点左右高潮式释放褪黑素是睡眠的启动因素。褪黑素受昼夜周期控制,只在黑暗中分泌,白天光照抑制其分泌,因而是最具有昼夜节律性的一种激素。
现在,研究发现,它不仅调控睡眠的昼夜节律性,还通过对葡萄糖刺激的胰岛素分泌的调控在糖尿病发生中具有重要作用。
免疫系统
免疫系统昼夜生物钟的调控,目前的研究也集中在糖皮质激素和褪黑激素的作用上。其中,先天免疫性中的T细胞,和关键的促炎细胞因子核因子NF-κB活性昼夜节律性分子机制获得可靠的证据支持。
生殖系统
女性动情和排卵周期节律性,众所周知。其中昼夜节律性调节机制研究获得了很大突破。近年来的研究发现,男性生殖细胞精子的生成也具有显著的时间节律性,当然这个节律周期不限于24小时昼夜变化。
以上所列举的仅仅是分子机制上获得证据支持的昼夜节律对生理和病理生理调控。这个领域,还有更大量的昼夜节律性生物活动的机制有待研究。短于24小时,长于24小时其他节律性机制同样有待于揭示。
总之,昼夜节律性在揭示人类几乎所有生理功能和某些相关病理变化中具有关键性作用。
那么,这些功能障碍中相关的基因到蛋白质编码合成环节,都可能成为新的疗法或药物的潜在靶点,帮助人类开发出针对性治疗。就是说,这项成就不仅存在重大理论意义,在实际应用方面同样具有重大的应用价值。